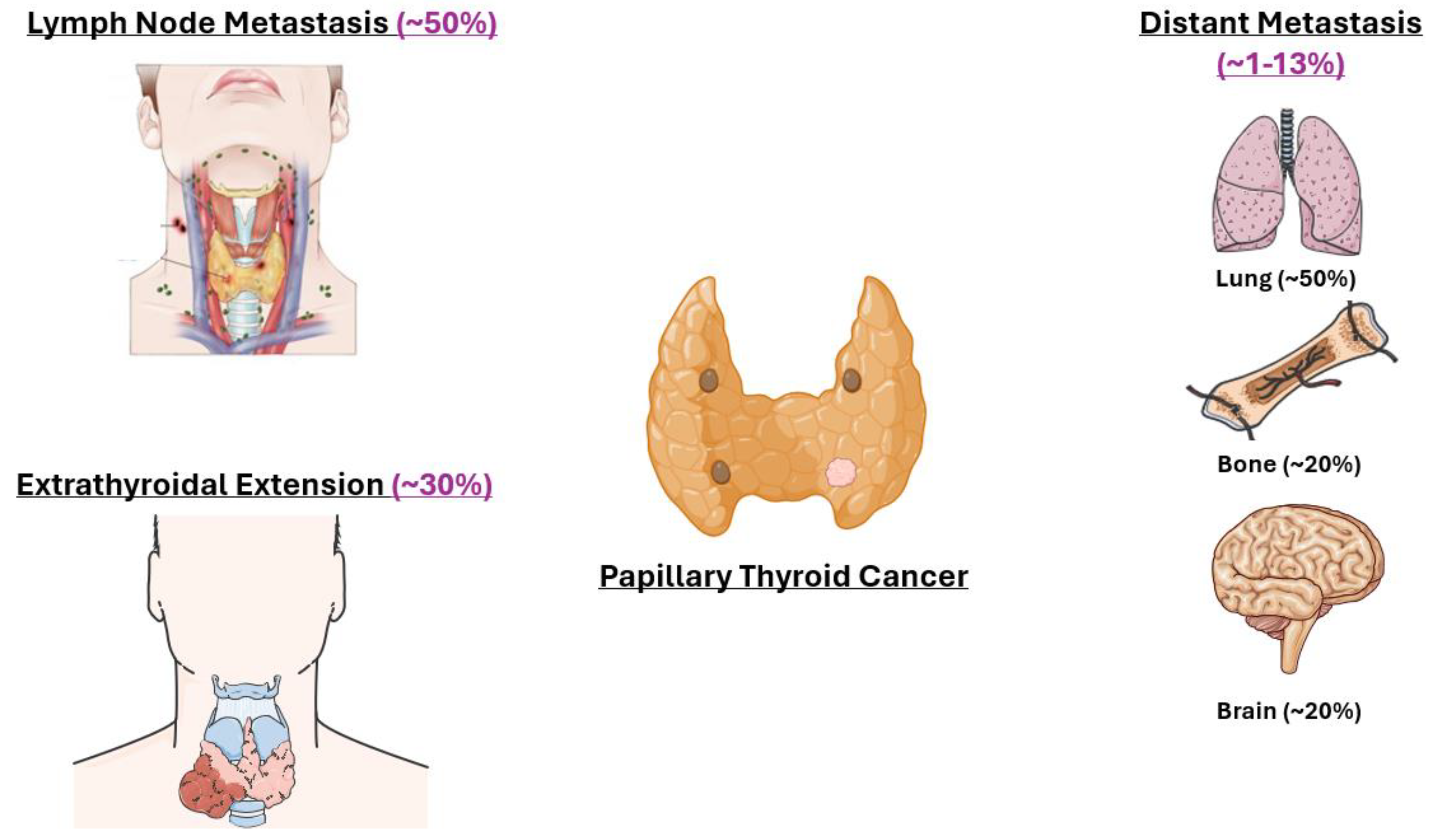
Ung thư tuyến giáp là khối u nội tiết phổ biến nhất ở trẻ em và người lớn, nữ giới thường có tỉ lệ mắc nhiều hơn. Khoảng 95% là ung thư tuyến giáp biệt hóa ở dạng nhú, một phần nhỏ dạng nang và khoảng 4% dạng tủy. Tương tự các ung thư khác, sự di căn là mối bận tâm chính của thư tuyến giáp. Mặc dù di căn xa trong ung thư tuyến giáp dạng nhú không phổ biến, nhưng khi xảy ra, các vị trí di căn xa phổ biến bao gồm di căn phổi (50%), não (20%) và tủy xương (20%).
Ở trẻ em, ung thư tuyến giáp biệt hóa thường có nguy cơ tái phát, di căn hạch cổ, di căn xa nhiều hơn so với người lớn, nhưng tỉ lệ tử vong thường <1%. Trước đây, việc điều trị ung thư tuyến giáp ơ trẻ em vẫn dựa trên hướng dẫn bệnh ở người lớn (cắt toàn bộ tuyến giáp và I-ốt phóng xạ) mặc dù hiệu quả nhưng kèm theo là những tác dụng phụ, biến chứng và tăng nguy cơ ung thư thứ phát. Trong 2 thập kỷ qua, đã có những tiến bộ đáng kể trong việc hiểu biết về cấu trúc phân tử của khối u tuyến giáp, thấy rằng nguyên nhân bệnh sinh do đột biến soma mắc phải cao hơn các nguyên nhân do bức xạ hoặc di truyền. Do đó, việc xác định các yếu tố nguy cơ liên quan đến sinh học phân tử của khối u đóng vai trò quang trọng trong chẩn đoán sớm và tiên lượng, mở ra cách tiếp cận điều trị đặc thù hơn.
Các phương pháp chẩn đoán ung thư tuyến giáp phổ biến như: siêu âm tuyến giáp nhằm đánh giá đặc điểm của nhân giáp – xác định nguy cơ ác tính; chọc hút kim nhỏ (FNA) nhằm xác định bản chất của nhân giáp và phân loại dựa theo hệ thống Bethesda; các xét nghiệm bổ sung như đo nồng độ thyroglobulin, calcitonin và xét nghiệm gen nếu cần thiết. Các mẫu sinh thiết sau phẫu thuật thường được xét nghiệm bằng phương pháp miễn dịch mô học (IHC) và lai huỳnh quang tại chỗ (FISH) giúp đánh giá mức độ xâm lấn của khối u, nguy cơ di căn, theo dõi và định hướng điều trị bổ trợ. Gần đây, một số nghiên cứu ở trẻ em cho rằng sự tổ hợp đột biến kinase các gen RET, NTRK và ALK có liên quan đến hầu hết các trường hợp bệnh ác tính (nguy cơ cao), đột biến gen BRAF (nguy cơ trung bình) và các đột biến gen RAS, DICER1 và PTEN (nguy cơ thấp) có thể liên quan đến hàng loạt các bệnh tuyến giáp ở trẻ em.
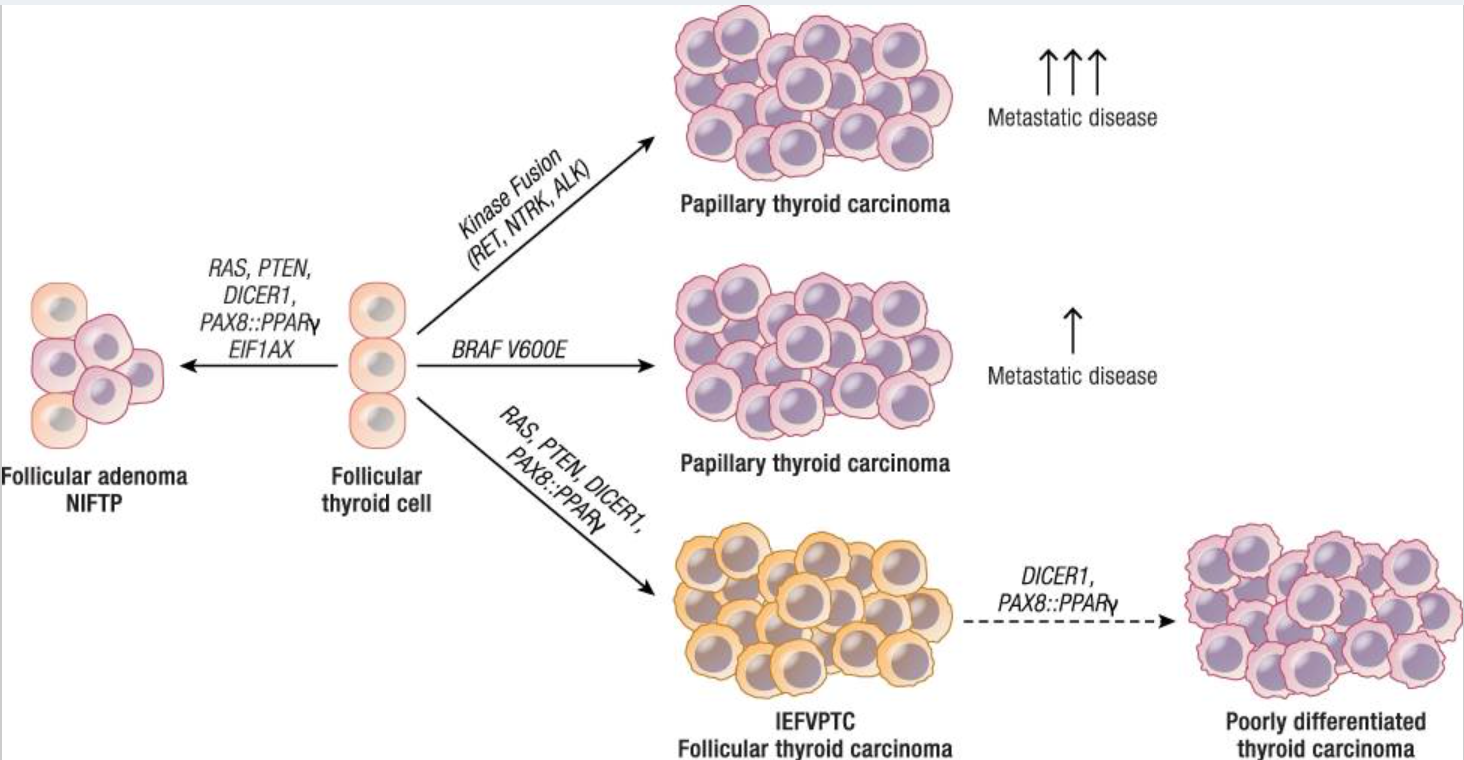
Với mục tiêu tăng độ nhạy của kết quả phân tích đột biến, các xét nghiệm gen trên mẫu FNA thường được thực hiện kết hợp với xét nghiệm microRNA. Kết quả dương tính gen RET, NTRK hoặc ALK gợi ý nguy cơ xâm lấn cao (di căn hạch bạch huyết và phổi), định hướng cắt toàn bộ tuyến giáp và bóc tách hạch; trong khi dương tính đột biến RAS thường ít xâm lấn hơn và có thể cho phép phẫu thuật cắt bỏ một phần tuyến giáp. Bên cạnh đó, việc xác định các đột biến dòng mầm giúp theo dõi, phát hiện sớm ung thư liên quan và phân tầng xét nghiệm cho những người có nguy cơ trong gia đình. Các xét nghiệm này hiện được khuyến cáo cho bệnh nhân ung thư tuyến giáp có các đặc điểm lâm sàng hoặc tiền sử gia đình gợi ý về hội chứng xu hướng ung thư.
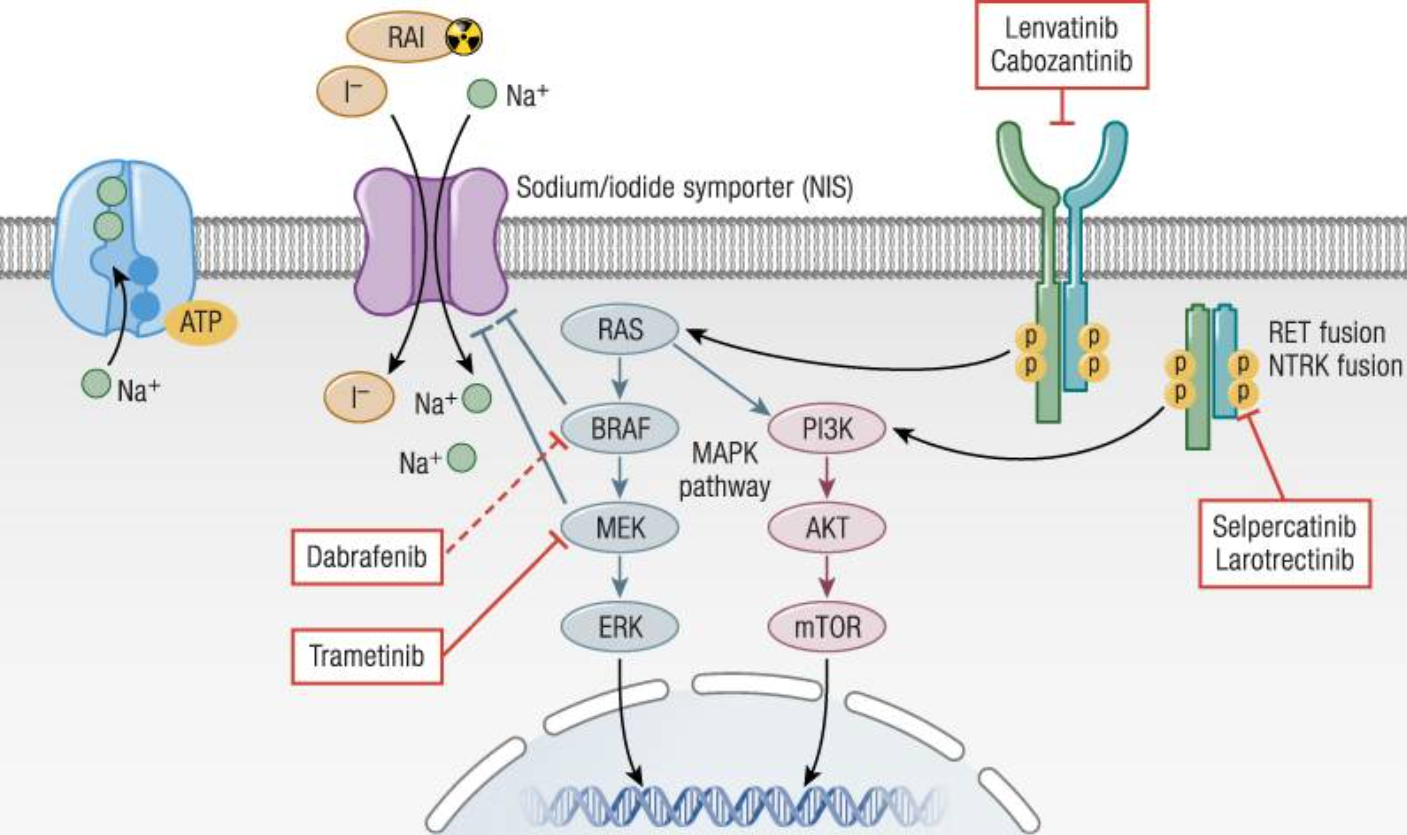
Trong điều trị, I-ốt phóng xạ được xem là liệu pháp chủ yếu sau phẫu thuật, tuy nhiên hiệu quả chưa cao trong trường hợp di căn phổi và đặc biệt trong một số trường hợp kháng I-ốt phóng xạ. Do đó xét nghiệm phân tử mở ra cơ hội áp dụng liệu pháp điều trị trúng đích cho bệnh nhân giai đoạn tiến triển hoặc kháng I-ốt phóng xạ. Các thuốc ức chế đa kinase và các chất ức chế đặc hiệu gen NTRK, RET, ALK, BRAF cho thấy hiệu quả 80–90% trong thoái triển bệnh và tăng hấp thu I-ốt phóng xạ; Larotrectinib hiện được nghiên cứu sử dụng cho bệnh nhân di căn hoặc dương tính NTRK tiến triển tại chỗ không thể phẫu thuật cắt bỏ, song cần thêm các nghiên cứu về liều tối ưu để hạn chế độc tính. Ngoài ra, liệu pháp nhắm trúng đích tân bổ trợ có thể giúp thu nhỏ khối u, cho phép phẫu thuật trong các trường hợp khó. Trong tương lai, liệu pháp nhắm trúng đích phân tử được kỳ vọng sẽ ngày càng được áp dụng rộng rãi để tăng tỷ lệ thuyên giảm ung thư tuyến giáp ở trẻ em.
Tài liệu tham khảo
- Vaccarella, J. Lortet-Tieulent, M. Colombet, et al., “Global Patterns and Trends in Incidence and Mortality of Thyroid Cancer in Children and Adolescents: A Population-Based Study,” Lancet Diabetes and Endocrinology 9 (2021): 144–152.
- E. Cherella and A. J. Wassner, “Pediatric Thyroid Cancer: Recent Developments,” Best Practice & Research. Clinical Endocrinology & Metabolism 37 (2023): 101715.
- L. Spaulding, M. Maayah, C. A. Dinauer, et al., “Molecular Genetics Augment Cytopathologic Evaluation and Surgical Planning of Pediatric Thyroid Nodules,” Journal of Pediatric Surgery 59 (2024): 975–980.
- Adeline T Yang, Sin-ting Tiffany Lai, Theodore W Laetsch, et al., “Molecular Landscape and Therapeutic Strategies in Pediatric Differentiated Thyroid Carcinoma”, Endocrine Reviews 46.3 (2025): 397–417.
- Michelle Carnazza, Danielle Quaranto, Nicole DeSouza, et al,, “The Current Understanding of the Molecular Pathogenesis of Papillary Thyroid Cancer”, International Journal of Molecular Sciences 26.10 (2025): 4646.
ThS. Trần Thị Mỹ Qui – KTXNYH
 1900 2039
1900 2039