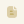- Kháng thể kháng tinh trùng là gì ?
Kháng thể kháng tinh trùng (Anti-sperm antibody – ASA) đã được báo cáo ở nam giới vô sinh sớm nhất là vào năm 1954 [1]. ASA là các globulin miễn dịch kháng lại các kháng nguyên có trên bề mặt tinh trùng [2, 3, 4]. Tinh trùng trưởng thành thường nằm phía sau hàng rào máu tinh hoàn. Vì vậy, về mặt sinh lý, tinh trùng không được tiếp xúc với hệ thống miễn dịch của nam giới. Tuy nhiên, khi hàng rào máu tinh hoàn bị phá vỡ hoặc bị tổn thương do chấn thương hoặc bệnh tật, các tế bào mầm trưởng thành (người mang kháng nguyên) sẽ tiếp xúc với hệ thống miễn dịch dẫn đến sự phát triển của ASA [5].
Mặc dù không phải tất cả ASA đều làm suy giảm chức năng của tinh trùng, nhưng ASA có thể làm thay đổi khả năng di động, phản ứng thể cực, khả năng hóa cũng như khả năng thụ tinh của tinh trùng [6, 7]. Vô sinh miễn dịch chỉ được chẩn đoán khi có bằng chứng về khả năng hoạt động của tinh trùng bị thay đổi do ASA [8, 9]. Tuy nhiên, các chỉ định xét nghiệm ASA vẫn chưa rõ ràng và ý nghĩa lâm sàng của việc phát hiện ASA trong huyết thanh vẫn còn nhiều nghi vấn. Tỷ lệ phổ biến lớn của ASA đã được báo cáo ở nam giới vô sinh (3,9% – 15,6%) [10, 11, 12, 13, 14], cao hơn đáng kể so với tỷ lệ được báo cáo ở nam giới có khả năng sinh sản (0,9% – 2,5%) [10, 12, 15]. Tuy nhiên, trong một nghiên cứu gần đây trên hơn 10.000 nam giới thuộc các cặp vợ chồng vô sinh, tỷ lệ mắc ASA không cao như mong đợi và ước tính vào khoảng 2% đến 4% [16].
- Nguồn gốc của kháng thể kháng tinh trùng ở nam giới
Các tế bào Sertoli chịu trách nhiệm hình thành hàng rào máu-tinh hoàn với các mối nối chặt chẽ giữa các tế bào giúp phân chia biểu mô tinh thành hai khoang, khoang đáy và khoang đỉnh, gọi chung là khoang adluminal [5]. Các tế bào mầm nằm trong khoang adluminal của biểu mô tinh được bảo vệ về mặt sinh lý khỏi sự tiếp xúc với hệ thống miễn dịch. Do đó, tinh trùng trưởng thành vẫn bị ẩn khỏi sự phát hiện của hệ thống miễn dịch. Do đó, phản ứng tự miễn dịch chống lại tinh trùng có thể xảy ra sau chấn thương tinh hoàn, mào tinh hoàn hoặc mạch dẫn đến tinh trùng tiếp xúc với hệ thống miễn dịch. Chấn thương phẫu thuật tinh hoàn hoặc bìu (điều trị hoặc do thầy thuốc), xoắn tinh hoàn, ung thư tinh hoàn, tinh hoàn ẩn, tình trạng viêm niệu sinh dục, tắc nghẽn hoặc giãn tĩnh mạch thừng tinh có liên quan đến sự hiện diện của ASA [17, 18, 19, 20, 21, 22, 23, 24, 25]. ASA có liên quan chặt chẽ đến tình trạng vô tinh do tắc nghẽn, đặc biệt là sau thắt ống dẫn tinh [25], vì ASA hiện diện ở 70% đến 100% nam giới sau khi thắt ống dẫn tinh [26]. Người ta cũng lưu ý rằng một số bệnh nhiễm trùng mãn tính do vi khuẩn có thể đi kèm với sự hiện diện của ASA. Ví dụ, bệnh nhân bị viêm tuyến tiền liệt mãn tính có nguy cơ phát triển ASA cao gấp 3 lần so với bệnh nhân đối chứng không mắc bệnh này [27, 28]. Cơ chế này chưa được hiểu đầy đủ nhưng có thể liên quan đến tổn thương viêm ở tuyến sinh dục nam, cũng như rối loạn điều hòa miễn dịch cục bộ có thể dẫn đến tự miễn dịch chống lại tinh trùng [27, 29, 30]. Người ta cũng gợi ý rằng ASA có thể được tạo ra trong các phản ứng miễn dịch chéo với các kháng nguyên ngoại sinh (vi khuẩn, vi rút, nấm, chất gây dị ứng) [29, 31, 32, 33]. Một nghiên cứu gần đây cho thấy rằng nhiễm virus HPV ở nam giới có liên quan đến nguy cơ phát triển ASA cao hơn [34]. Cuối cùng, trong nhiều trường hợp, nguyên nhân của những kháng thể này vẫn chưa được xác định rõ hoặc vẫn là vô căn [35].
- Ý nghĩa của xét nghiệm phát hiện ASA
Các chỉ định xét nghiệm ASA trong điều trị vô sinh nam thường dựa trên tiền sử bệnh nhân và kết quả phân tích tinh dịch định kỳ. Tiền sử gợi ý bất kỳ tình trạng nào nêu trên có thể đảm bảo thực hiện xét nghiệm ASA. Tương tự, một số thông số tinh dịch nhất định có thể cho thấy sự hiện diện của ASA. Sự ngưng kết tinh trùng là một chỉ số quan trọng để tiến hành xét nghiệm ASA [6], mặc dù mối liên quan giữa ngưng kết tinh trùng và ASA không mạnh và sự ngưng kết tinh trùng có thể xảy ra do các yếu tố khác ngoài kháng thể tinh trùng [8, 15, 36]. Gần đây, một nghiên cứu được tiến hành trên 195 bệnh nhân có ASA trong tinh dịch đã điều tra mối liên hệ giữa sự ngưng kết tinh trùng và ASA [37]. Đáng chú ý, hơn một phần ba số bệnh nhân bị ngưng kết tinh trùng có ASA với tình trạng ngưng kết tinh trùng, so với dưới 3% bệnh nhân không bị ngưng kết tinh trùng [37]. Sổ tay hướng dẫn phòng thí nghiệm của WHO năm 2010 về kiểm tra và xử lý tinh dịch người mô tả sự ngưng kết tinh trùng là gợi ý về sự hiện diện của ASA [8].
Sự hiện diện của ASA cũng liên quan đáng kể đến việc giảm số lượng, khả năng vận động và sức sống của tinh trùng và theo một phân tích tổng hợp trước đó, suy nhược tinh trùng có thể là một chỉ số để xét nghiệm [38]. Tuy nhiên, một nghiên cứu khác liên quan đến một nhóm lớn bệnh nhân mắc ASA đã chứng minh rằng khả năng di chuyển của tinh trùng không tương quan với sự hiện diện của IgA [16]. Do đó, vẫn chưa rõ liệu có nên xét nghiệm ASA ở tất cả bệnh nhân mắc chứng suy nhược tinh trùng hay không. Một số nghiên cứu đã chứng minh rằng xét nghiệm ASA chỉ nên được xem xét trong trường hợp suy giảm tinh trùng với sự ngưng kết tinh trùng và nồng độ tinh trùng bình thường [39, 40, 41]. Tóm lại, sự hiện diện của ASA có thể bị nghi ngờ khi có bất kỳ tiền sử gợi ý nào về sự ngưng kết tinh trùng bất kể chúng có liên quan đến chứng suy nhược tinh trùng hay không.
- Các phương pháp xét nghiệm sự hiện diện ASA
ASA trong tinh dịch hầu như chỉ thuộc về hai nhóm globulin miễn dịch là IgA và IgG [8]. Kháng thể IgA có thể có tầm quan trọng lâm sàng lớn hơn kháng thể IgG, nhưng hơn 95% trường hợp có kháng thể tinh trùng IgA cũng dương tính với IgG [8, 9]. ASA có thể được đo bằng các xét nghiệm trực tiếp hoặc gián tiếp.
Trong các thử nghiệm trực tiếp bằng phương pháp hạt miễn dịch, mẫu được ủ bằng các hạt latex được phủ kháng thể kháng lại kháng thể của người. Nếu có ASA trong mẫu, kháng thể kháng người trên hạt sẽ liên kết với kháng thể trên bề mặt tinh trùng: dưới kính hiển vi, tinh trùng di động sẽ xuất hiện được phủ một lớp hạt. Tỷ lệ tinh trùng di động có gắn hạt cũng có thể được tính toán. Những xét nghiệm trực tiếp này cung cấp thông tin về sự hiện diện của globulin miễn dịch, loại kháng thể và vị trí cụ thể của chúng trên đầu, phần giữa, đuôi hoặc cả ba vùng của tinh trùng [8]. Xét nghiệm trực tiếp phụ thuộc vào sự hiện diện của tinh trùng di động, do đó, trong trường hợp số lượng tinh trùng di động không đủ (dưới 100) thì phải sử dụng xét nghiệm gián tiếp.
Xét nghiệm gián tiếp được sử dụng để đo các globulin miễn dịch đặc hiệu của tinh trùng trong mẫu dạng lỏng không có chứa tinh trùng như huyết tương tinh dịch, huyết thanh bất hoạt nhiệt và chất nhầy cổ tử cung hòa tan. Xét nghiệm gián tiếp sử dụng chất lỏng nghi ngờ được ủ với tinh trùng của người hiến tặng không có ASA được lọc rửa từ tinh dịch ban đầu [9]. Khi mẫu của bệnh nhân thuộc dạng thiểu tinh hoặc vô tinh, trong trường hợp vô tinh do tắc nghẽn hoặc nếu không thể xét nghiệm mẫu thì có thể thực hiện xét nghiệm gián tiếp và tinh dịch có thể được đông lạnh và bảo quản cho đến thời điểm xét nghiệm.
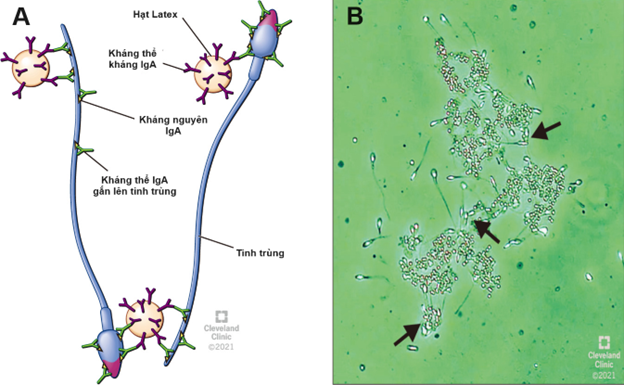
Hình minh họa phương pháp phát hiện ASA bằng hạt miễn dịch
- Nguyên lý tinh trùng kết dính với hạt latex trong xét nghiệm hạt miễn dịch.
- Kết quả mẫu dương tính với ASA. Mũi tên biểu thị tinh trùng gắn lên hạt latex.
ThS. Quốc Kỳ Duyên – Khoa KTXNYH (Tổng hợp)
TÀI LIỆU THAM KHẢO
- Wilson L. Sperm agglutinins in human semen and blood. Proc Soc Exp Biol Med. 1954;85:652–655.
- Vazquez-Levin MH, Marín-Briggiler CI, Veaute C. Antisperm antibodies: invaluable tools toward the identification of sperm proteins involved in fertilization. Am J Reprod Immunol. 2014;72:206–218.
- Mazumdar S, Levine AS. Antisperm antibodies: etiology, pathogenesis, diagnosis, and treatment. Fertil Steril. 1998;70:799–810.
- Restrepo B, Cardona-Maya W. Antisperm antibodies and fertility association. Actas Urol Esp. 2013;37:571–578.
- Kaur G, Thompson LA, Dufour JM. Sertoli cells–immunological sentinels of spermatogenesis. Semin Cell Dev Biol. 2014;30:36–44.
- Francavilla F, Santucci R, Barbonetti A, Francavilla S. Naturally-occurring antisperm antibodies in men: interference with fertility and clinical implications. An update. Front Biosci. 2007;12:2890–2911.
- Lombardo F, Gandini L, Dondero F, Lenzi A. Antisperm immunity in natural and assisted reproduction. Hum Reprod Update. 2001;7:450–456.
- World Health Organization (WHO) WHO laboratory manual for the examination and processing of human semen.5th ed. Geneva: WHO; 2010.
- World Health Organization (WHO) WHO laboratory manual for the examination and processing of human semen.6th ed. Geneva: WHO; 2021. p. 292.
- Sinisi AA, Di Finizio B, Pasquali D, Scurini C, D’Apuzzo A, Bellastella A. Prevalence of antisperm antibodies by SpermMARtest in subjects undergoing a routine sperm analysis for infertility. Int J Androl. 1993;16:311–314.
- Tüttelmann F, Nieschlag E. In: Andrology: male reproductive health and dysfunction.Nieschlag E, Behre HM, Nieschlag S, editors. Berlin: Springer; 2010. Classification of andrological disorders; pp. 87–92.
- Bozhedomov VA, Nikolaeva MA, Ushakova IV, Lipatova NA, Bozhedomova GE, Sukhikh GT. Functional deficit of sperm and fertility impairment in men with antisperm antibodies. J Reprod Immunol. 2015;112:95–101.
- Yasin AL, Yasin AL, Basha WS. The epidemiology of anti-sperm antibodies among couples with unexplained infertility in North West Bank, Palestine. J Clin Diagn Res. 2016;10:QC01–QC03.
- European Association of Urology (EAU) EAU guidelines.Arnhem: EAU; 2021.
- Heidenreich A, Bonfig R, Wilbert DM, Strohmaier WL, Engelmann UH. Risk factors for antisperm antibodies in infertile men. Am J Reprod Immunol. 1994;31:69–76.
- Barbonetti A, Castellini C, D’Andrea S, Cordeschi G, Santucci R, Francavilla S, et al. Prevalence of anti-sperm antibodies and relationship of degree of sperm auto-immunization to semen parameters and post-coital test outcome: a retrospective analysis of over 10 000 men. Hum Reprod. 2019;34:834–841.
- Bonyadi MR, Madaen SK, Saghafi M. Effects of varicocelectomy on anti-sperm antibody in patients with varicocele. J Reprod Infertil. 2013;14:73–78.
- Hellema HW, Samuel T, Rumke P. Sperm autoantibodies as a consequence of vasectomy. II. Long-term follow-up studies. Clin Exp Immunol. 1979;38:31–36.
- Mahmoud AM, Tuyttens CL, Comhaire FH. Clinical and biological aspects of male immune infertility: a case-controlled study of 86 cases. Andrologia. 1996;28:191–196.
- Koşar A, Küpeli B, Alçigir G, Ataoglu H, Sarica K, Küpeli S. Immunologic aspect of testicular torsion: detection of antisperm antibodies in contralateral testicle. Eur Urol. 1999;36:640–644.
- Höbarth K, Klingler HC, Maier U, Kollaritsch H. Incidence of antisperm antibodies in patients with carcinoma of the testis and in subfertile men with normogonadotropic oligoasthenoteratozoospermia. Urol Int. 1994;52:162–165.
- Lu SM, Li X, Wang SL, Yang XL, Xu YZ, Huang LL, et al. Success rates of in vitro fertilization versus intracytoplasmic sperm injection in men with serum anti-sperm antibodies: a consecutive cohort study. Asian J Androl. 2019;21:473–477.
- Sinisi AA, Pasquali D, Papparella A, Valente A, Orio F, Esposito D, et al. Antisperm antibodies in cryptorchidism before and after surgery. J Urol. 1998;160:1834–1837.
- Domagala A, Havryluk A, Nakonechnyj A, Kamieniczna M, Chopyak V, Kurpisz M. Antisperm antibodies in prepubertal boys with cryptorchidism. Arch Androl. 2006;52:411–416.
- Lee R, Goldstein M, Ullery BW, Ehrlich J, Soares M, Razzano RA, et al. Value of serum antisperm antibodies in diagnosing obstructive azoospermia. J Urol. 2009;181:264–269.
- Parslow JM, Royle MG, Kingscott MM, Wallace DM, Hendry WF. The effects of sperm antibodies on fertility after vasectomy reversal. Am J Reprod Immunol. 1983;3:28–31.
- Jiang Y, Cui D, Du Y, Lu J, Yang L, Li J, et al. Association of anti-sperm antibodies with chronic prostatitis: a systematic review and meta-analysis. J Reprod Immunol. 2016;118:85–91.
- Condorelli RA, Russo GI, Calogero AE, Morgia G, La Vignera S. Chronic prostatitis and its detrimental impact on sperm parameters: a systematic review and meta-analysis. J Endocrinol Invest. 2017;40:1209–1218.
- Boitrelle F, Robin G, Lefebvre C, Bailly M, Selva J, Courcol R, et al. [Bacteriospermia in assisted reproductive techniques: effects of bacteria on spermatozoa and seminal plasma, diagnosis and treatment] Gynecol Obstet Fertil. 2012;40:226–234. French.
- Wigby S, Suarez SS, Lazzaro BP, Pizzari T, Wolfner MF. Sperm success and immunity. Curr Top Dev Biol. 2019;135:287–313.
- Kalaydjiev S, Dimitrova D, Mitov I, Dikov I, Nakov L. Serum sperm antibodies after diarrhoeal diseases. Andrologia. 2007;39:101–108.
- Thaper D, Prabha V. Molecular mimicry: an explanation for autoimmune diseases and infertility. Scand J Immunol. 2018;88:e12697.
- Dimitrova-Dikanarova DK, Lazarov V V, Tafradjiiska-Hadjiolova R, Dimova II, Petkova NU, Krastev ZA. Association between Helicobacter pyloriinfection and the presence of anti-sperm antibodies. Biotechnol Biotechnol Equip. 2017;31:1–8.
- Piroozmand A, Mousavi Nasab SD, Erami M, Hashemi SMA, Khodabakhsh E, Ahmadi N, et al. Distribution of human papillomavirus and antisperm antibody in semen and its association with semen parameters among infertile men. J Reprod Infertil. 2020;21:183–188.
- Djaladat H, Mehrsai A, Rezazade M, Djaladat Y, Pourmand G. Varicocele and antisperm antibody: fact or fiction? South Med J. 2006;99:44–47.
- Dimitrov DG, Urbánek V, Zvĕrina J, Madar J, Nouza K, Kinský R. Correlation of asthenozoospermia with increased antisperm cell-mediated immunity in men from infertile couples. J Reprod Immunol. 1994;27:3–12.
- Verón GL, Molina RI, Tissera AD, Estofan GM, Marín-Briggiler CI, Vazquez-Levin MH. Incidence of sperm surface autoantibodies and relationship with routine semen parameters and sperm kinematics. Am J Reprod Immunol. 2016;76:59–69.
- Cui D, Han G, Shang Y, Liu C, Xia L, Li L, et al. Antisperm antibodies in infertile men and their effect on semen parameters: a systematic review and meta-analysis. Clin Chim Acta. 2015;444:29–36.
- Schlegel PN, Sigman M, Collura B, De Jonge CJ, Eisenberg ML, Lamb DJ, et al. Diagnosis and treatment of infertility in men: AUA/ASRM guideline part I. J Urol. 2021;205:36–43.
- Schlegel PN, Sigman M, Collura B, De Jonge CJ, Eisenberg ML, Lamb DJ, et al. Diagnosis and treatment of infertility in men: AUA/ASRM guideline part II. Fertil Steril. 2021;115:62–69.
- Schlegel PN, Sigman M, Collura B, De Jonge CJ, Eisenberg ML, Lamb DJ. Diagnosis and treatment of infertility in men: AUA/ASRM guideline [Internet] Linthicum Heights (MD): American Urological Association; c2020. [cited 2021 Jun 30].
 1900 2039
1900 2039